推荐产品
公司新闻/正文
【热点应用】高级多检测器 SEC 表征腺相关病毒载体的方法
1685 人阅读发布时间:2022-02-14 15:24
#本文由马尔文帕纳科应用专家冯慧庆供稿#
基因治疗是生物制药行业中一个快速增长的领域,通过基因治疗可实现疾病的治疗或预防。其中,重组腺相关病毒 (rAAV) 是目前基因治疗领域研究较多的一类病毒载体。
腺相关病毒(adeno-associated virus, AAV)是微小病毒科(Parvoviridae)家族的成员之一,一般,研究中采用的重组腺相关病毒载体(Recombination adeno-associated virus, rAAV)是在非致病的野生型 AAV 基础上改造而成的基因载体,由于其种类多样、免疫原性极低、安全性高、宿主细胞范围广、扩散能力强、体内表达基因时间长等,rAAV 被视为最有前途的基因研究和基因治疗载体之一。
目前,rAAV 的准确定量分析和表征的难度是阻碍基因治疗快速发展的关键因素。我们常常需要对 rAAV 进行综合全面表征,比如衣壳数量、实心率、颗粒尺寸、聚集体比例等。传统情况,rAAV 滴度和病毒载量采用 ELISA、ddPCR、AUC 和 EM 等技术进行测量。但这些方法通常费时费力,而且精确度不高。
本文通过 GPC/SEC 和多角度动态光散射(MADLS)两种分析技术分析 rAAV5 样品,展示了快速、准确和可靠地定量测量AAV的病毒滴度(AAV Titer)和实心率 (% full AAV) 的方法。
01仪器参数
OMNISEC GPC/SEC 多检测器系统非常适合于生物医药行业,可用于全面表征 rAAV 样品。OMNISEC 包含一个示差折光检测器(RI),紫外线全波长阵列检测器 (UV-Vis 190-900 nm) 和光散射检测器,仅需一次进样,可精确测量绝对分子量、聚集体比例、病毒滴度和实心率。
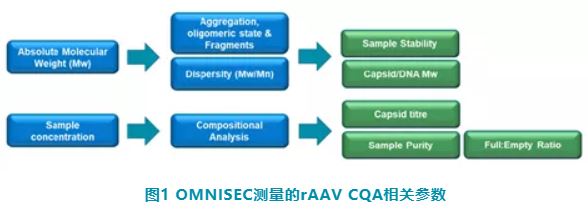
与传统 HPLC 不同,测量过程不依赖柱保留体积,也不需要一系列标样进行色谱柱校正。图1显示了使用 OMNISEC 测量的 CQA 关键质量参数。
02检测方法
我们采用 Empty 和 Full rAAV5 两个样品作为分析案例。Full rAAV5 载有已知分子量为 785 kg/mol 的 PFB-GFP ssDNA。经 qPCR 和 ELISA 测量方式可知,该样本的病毒滴度为 2.5x1013。
采用色谱柱 P4000 和 P3000 串联,对 rAAV 样品的进行色谱分离。由 OMNISEC 软件采集分析测试结果,其中硬件系统包含 OMNISEC RESOLVE (包含泵、自动进样器和柱温箱)和 OMNISEC REVEAL(包含示差、UV/PDA 和直角 90° /小角 7° 光散射检测器)。
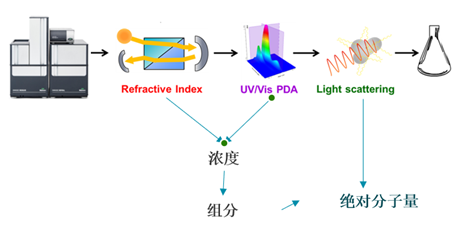
样品经过分离洗脱后,使用共聚物分析方法确定样品两种不同组分的浓度和分子量。计算方法如下:

其中,ConcCapsid 是衣壳浓度 (mg/mL),NA 是阿伏伽德罗数,Mwcapsid 是衣壳的分子量 (g/mol),ConcDNA 是 DNA 浓度 (mg/mL),MwSeqDNA 是来自序列的 ssDNA 的分子量。因此,通过计算出的颗粒浓度,可以很容易地得出样品实心率的百分比。
03检测结果
案例一:
图 2 显示了 Empty rAAV5 的三检测色谱图。RI 信号由红色曲线表示,260 nm 紫外信号由紫色曲线表示,直角光散射 (RALS) 信号由绿色曲线表示。样品包含四个部分:单体峰保留体积 (RV) 在 12.5ml,碎片在 16ml ,二聚体在 10.5ml ,聚集体在8.5ml 。使用共聚物分析方法,可以得到表 1 结果。
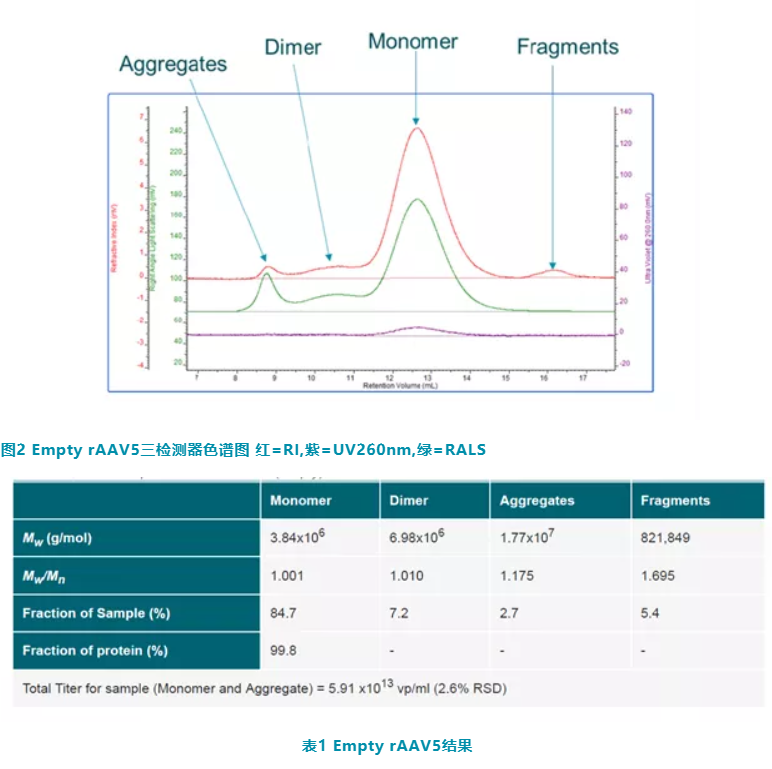
单体的分子量为 3.84×106g/mol。衣壳的理论分子量为 3.8×106g/mol,证实分析结果与预期相符。
MW/Mn 为分子量分布,描述了样品的分散性,单体和二聚体的值接近 1,而聚集体和片段均显着高于 1,表明在同一峰内有多个不同分子量的组分。
Fraction of Sample 表示样品组分百分含量,单体所占百分比为 84.7%。
Fraction of Protein 显示了样品中衣壳的百分比,单体包含 99.8% 的衣壳。这证实了样本确实是 Empty rAAV5。
最后 Empty rAAV5 样品总滴度为 5.91x1013Vp/ml。
案例二:
第二个样品 Full rAAV5 的三检测器色谱图如图3所示。图中显示了与 Empty rAAV5 截然不同的色谱峰。分析色谱图可以看出,只包含两个不同的组分,其中单体峰,大概 12.5ml RV 处,包含 Full 和 Empty rAAV5 的混合物,而聚集体出现在 8ml RV 处。测试结果见表 2。
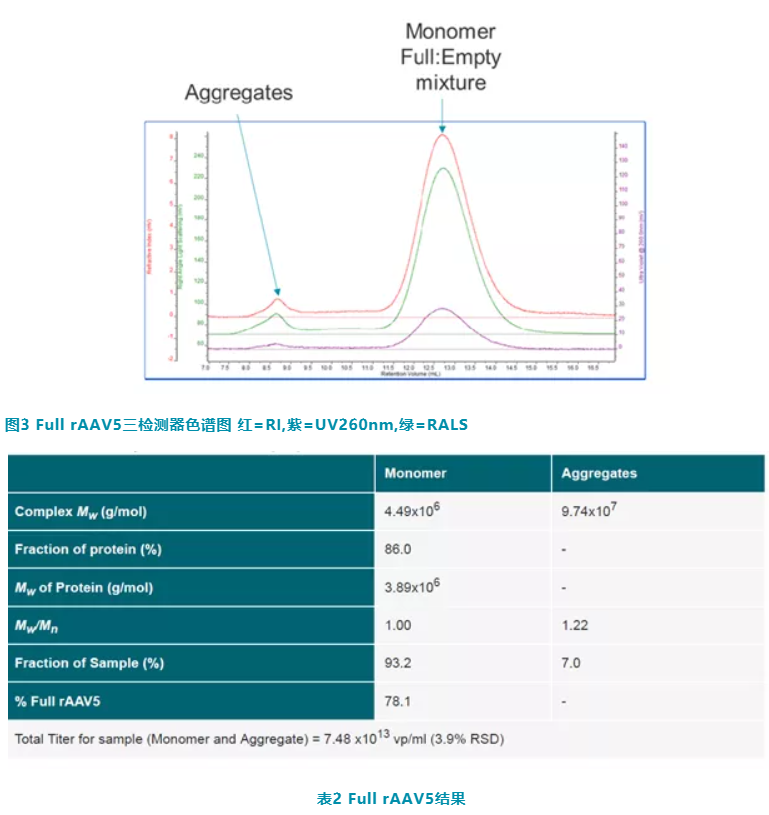
对于主体的单体峰,计算出其混合物分子量为 4.49×106g/mol,其中 86% 为衣壳。rAAV5 的蛋白质组分的分子量为 3.89×106g/mol,这与表 1 中 Empty rAAV5 的数据一致。单体是总体的 93.2%,样本的总滴度为 7.48x1013VP/ml 。其中单体包含78% Full rAAV5,22% Empty rAAV5。需要注意的是,这种分析方法假设样品要么是 Full ,要么是 Empty ,忽略部分装载或过度装载情况。
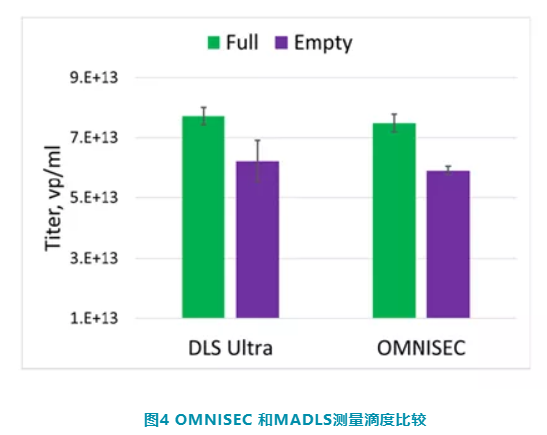
Zetasizer Ultra 纳米粒度及电位仪可以使用 MADLS 方式快速确定病毒滴度。从 OMNISEC 获得的数据与 Zetasizer Ultra 的粒子滴度进行了比较,两种技术之间有很好的相关性,见图 4。
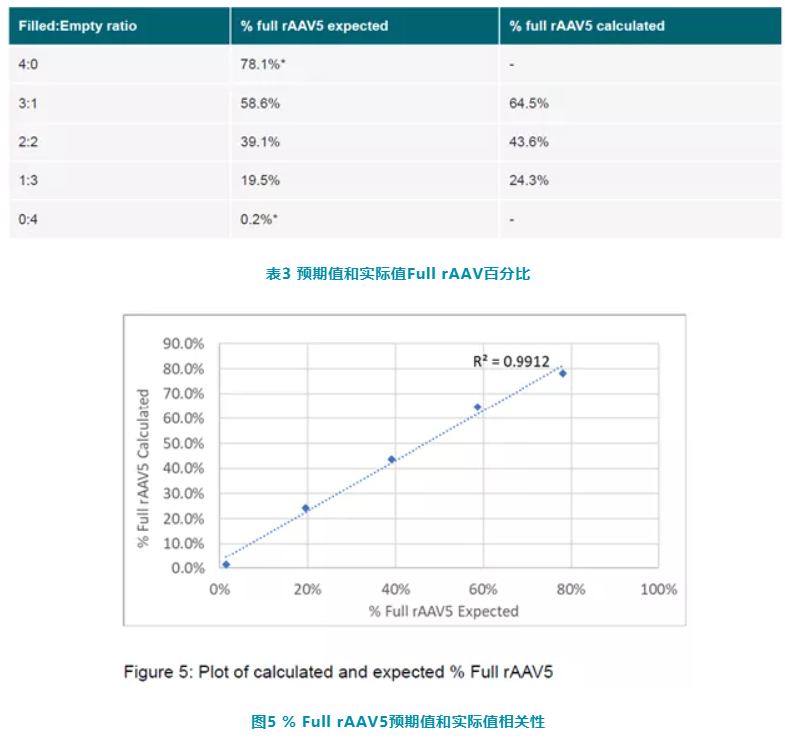
另外,本文将 Full rAAV5 和 Empty rAAV5 以确定比例混合,来对 Full rAAV5 样品进行分析。表3显示了每个样品的预期值和实际值 Full rAAV 百分比。图 5 显示了期望值和实际值之间有很强的相关性,证实了 OMNISEC 确定样品实心率结果的可靠性。
为了进一步评估 OMNISEC 对 rAAV 样品准确表征能力,我们进行了 rAAV5 样品的热应力稳定性研究,同时,基于 ZS Ultra 对聚集体的极高灵敏度,我们利用了 ZS Ultra 表征 rAAV5 聚集体的微小变化。测试条件是将 rAAV5 样品置于 25oC 到80oC 之间进行测试。
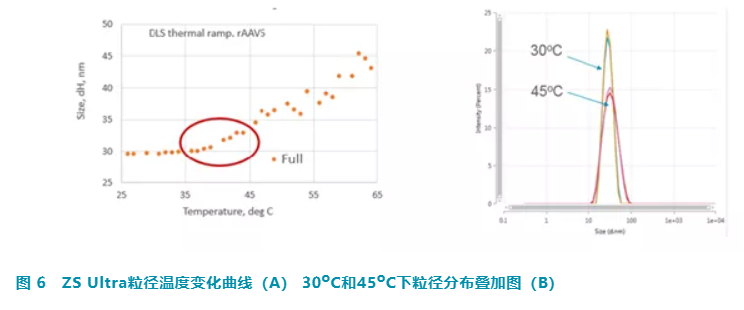
在不断加热过程中,在每个温度下测量 rAAV5 样品的粒径。在 25oC 和 35oC 之间,没有观察到粒径的变化。从 35oC 开始,可以观察到粒径开始增大,这表明样品开始发生变化 (图 6A)。30oC 和 45oC 下的数据比较清楚地显示了这些样品之间的大小差异(图 6B)。我们选择 45oC 条件,对 OMNISEC 进行进一步稳定性研究。
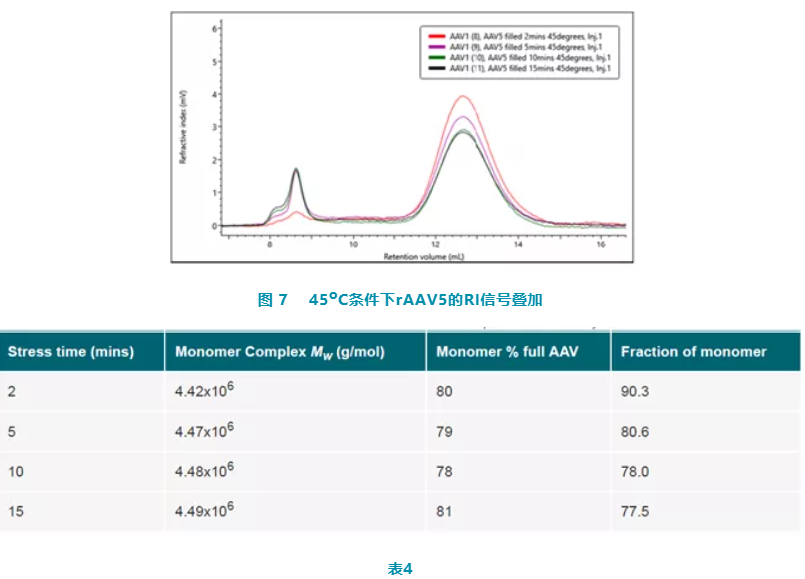
将 rAAV5 样品在稳定在 45oC,分别在 2min 、5min、10min 和 15min 后,取样品到 OMNISEC 上测试。图7色谱叠加图显示样品发生了明显的变化,聚集体百分含量增加,单体浓度含量降低。表 4 显示 MW 在此潜伏期内保持稳定,单体峰中的AAV百分比也保持稳定。
结论:
在这项研究中,我们展示了 OMNISEC 和 Zetasizer Ultra 在综合分析表征 rAAV5 样品的能力,以及将两者联合使用的应用价值。
OMNISEC 多检测 SEC 系统将示差折光检测器、紫外全波长检测器、光散射检测器集成一体化设计,具有更高的灵敏度和准确度,通过一次进样分析,可提供各种血清型 AAV 样品的绝对分子量、衣壳大小、滴度、实心率、聚集体、片段和样品稳定性等关键质量属性。虽然这些参数中很多都可以使用传统的生物化学方法来确定,但 OMNISEC 提供了更为简单、可靠的方法,正逐渐成为一种表征分析 AAV 通用的技术工具。
基因治疗是生物制药行业中一个快速增长的领域,通过基因治疗可实现疾病的治疗或预防。其中,重组腺相关病毒 (rAAV) 是目前基因治疗领域研究较多的一类病毒载体。
腺相关病毒(adeno-associated virus, AAV)是微小病毒科(Parvoviridae)家族的成员之一,一般,研究中采用的重组腺相关病毒载体(Recombination adeno-associated virus, rAAV)是在非致病的野生型 AAV 基础上改造而成的基因载体,由于其种类多样、免疫原性极低、安全性高、宿主细胞范围广、扩散能力强、体内表达基因时间长等,rAAV 被视为最有前途的基因研究和基因治疗载体之一。
目前,rAAV 的准确定量分析和表征的难度是阻碍基因治疗快速发展的关键因素。我们常常需要对 rAAV 进行综合全面表征,比如衣壳数量、实心率、颗粒尺寸、聚集体比例等。传统情况,rAAV 滴度和病毒载量采用 ELISA、ddPCR、AUC 和 EM 等技术进行测量。但这些方法通常费时费力,而且精确度不高。
本文通过 GPC/SEC 和多角度动态光散射(MADLS)两种分析技术分析 rAAV5 样品,展示了快速、准确和可靠地定量测量AAV的病毒滴度(AAV Titer)和实心率 (% full AAV) 的方法。
01仪器参数
OMNISEC GPC/SEC 多检测器系统非常适合于生物医药行业,可用于全面表征 rAAV 样品。OMNISEC 包含一个示差折光检测器(RI),紫外线全波长阵列检测器 (UV-Vis 190-900 nm) 和光散射检测器,仅需一次进样,可精确测量绝对分子量、聚集体比例、病毒滴度和实心率。
与传统 HPLC 不同,测量过程不依赖柱保留体积,也不需要一系列标样进行色谱柱校正。图1显示了使用 OMNISEC 测量的 CQA 关键质量参数。

02检测方法
我们采用 Empty 和 Full rAAV5 两个样品作为分析案例。Full rAAV5 载有已知分子量为 785 kg/mol 的 PFB-GFP ssDNA。经 qPCR 和 ELISA 测量方式可知,该样本的病毒滴度为 2.5x1013。
采用色谱柱 P4000 和 P3000 串联,对 rAAV 样品的进行色谱分离。由 OMNISEC 软件采集分析测试结果,其中硬件系统包含 OMNISEC RESOLVE (包含泵、自动进样器和柱温箱)和 OMNISEC REVEAL(包含示差、UV/PDA 和直角 90° /小角 7° 光散射检测器)。

样品经过分离洗脱后,使用共聚物分析方法确定样品两种不同组分的浓度和分子量。计算方法如下:

其中,ConcCapsid 是衣壳浓度 (mg/mL),NA 是阿伏伽德罗数,Mwcapsid 是衣壳的分子量 (g/mol),ConcDNA 是 DNA 浓度 (mg/mL),MwSeqDNA 是来自序列的 ssDNA 的分子量。因此,通过计算出的颗粒浓度,可以很容易地得出样品实心率的百分比。
03检测结果
案例一:
图 2 显示了 Empty rAAV5 的三检测色谱图。RI 信号由红色曲线表示,260 nm 紫外信号由紫色曲线表示,直角光散射 (RALS) 信号由绿色曲线表示。样品包含四个部分:单体峰保留体积 (RV) 在 12.5ml,碎片在 16ml ,二聚体在 10.5ml ,聚集体在8.5ml 。使用共聚物分析方法,可以得到表 1 结果。

单体的分子量为 3.84×106g/mol。衣壳的理论分子量为 3.8×106g/mol,证实分析结果与预期相符。
MW/Mn 为分子量分布,描述了样品的分散性,单体和二聚体的值接近 1,而聚集体和片段均显着高于 1,表明在同一峰内有多个不同分子量的组分。
Fraction of Sample 表示样品组分百分含量,单体所占百分比为 84.7%。
Fraction of Protein 显示了样品中衣壳的百分比,单体包含 99.8% 的衣壳。这证实了样本确实是 Empty rAAV5。
最后 Empty rAAV5 样品总滴度为 5.91x1013Vp/ml。
案例二:
第二个样品 Full rAAV5 的三检测器色谱图如图3所示。图中显示了与 Empty rAAV5 截然不同的色谱峰。分析色谱图可以看出,只包含两个不同的组分,其中单体峰,大概 12.5ml RV 处,包含 Full 和 Empty rAAV5 的混合物,而聚集体出现在 8ml RV 处。测试结果见表 2。

对于主体的单体峰,计算出其混合物分子量为 4.49×106g/mol,其中 86% 为衣壳。rAAV5 的蛋白质组分的分子量为 3.89×106g/mol,这与表 1 中 Empty rAAV5 的数据一致。单体是总体的 93.2%,样本的总滴度为 7.48x1013VP/ml 。其中单体包含78% Full rAAV5,22% Empty rAAV5。需要注意的是,这种分析方法假设样品要么是 Full ,要么是 Empty ,忽略部分装载或过度装载情况。
Zetasizer Ultra 纳米粒度及电位仪可以使用 MADLS 方式快速确定病毒滴度。从 OMNISEC 获得的数据与 Zetasizer Ultra 的粒子滴度进行了比较,两种技术之间有很好的相关性,见图 4。

另外,本文将 Full rAAV5 和 Empty rAAV5 以确定比例混合,来对 Full rAAV5 样品进行分析。表3显示了每个样品的预期值和实际值 Full rAAV 百分比。图 5 显示了期望值和实际值之间有很强的相关性,证实了 OMNISEC 确定样品实心率结果的可靠性。

为了进一步评估 OMNISEC 对 rAAV 样品准确表征能力,我们进行了 rAAV5 样品的热应力稳定性研究,同时,基于 ZS Ultra 对聚集体的极高灵敏度,我们利用了 ZS Ultra 表征 rAAV5 聚集体的微小变化。测试条件是将 rAAV5 样品置于 25oC 到80oC 之间进行测试。

在不断加热过程中,在每个温度下测量 rAAV5 样品的粒径。在 25oC 和 35oC 之间,没有观察到粒径的变化。从 35oC 开始,可以观察到粒径开始增大,这表明样品开始发生变化 (图 6A)。30oC 和 45oC 下的数据比较清楚地显示了这些样品之间的大小差异(图 6B)。我们选择 45oC 条件,对 OMNISEC 进行进一步稳定性研究。
将 rAAV5 样品在稳定在 45oC,分别在 2min 、5min、10min 和 15min 后,取样品到 OMNISEC 上测试。图7色谱叠加图显示样品发生了明显的变化,聚集体百分含量增加,单体浓度含量降低。表 4 显示 MW 在此潜伏期内保持稳定,单体峰中的AAV百分比也保持稳定。

结论:
在这项研究中,我们展示了 OMNISEC 和 Zetasizer Ultra 在综合分析表征 rAAV5 样品的能力,以及将两者联合使用的应用价值。
OMNISEC 多检测 SEC 系统将示差折光检测器、紫外全波长检测器、光散射检测器集成一体化设计,具有更高的灵敏度和准确度,通过一次进样分析,可提供各种血清型 AAV 样品的绝对分子量、衣壳大小、滴度、实心率、聚集体、片段和样品稳定性等关键质量属性。虽然这些参数中很多都可以使用传统的生物化学方法来确定,但 OMNISEC 提供了更为简单、可靠的方法,正逐渐成为一种表征分析 AAV 通用的技术工具。







